 |
|
|
振興醫院 臨床病理科顧問醫師 雍建輝
台北榮總 輸血醫學科主治醫師 林炯熙 |
簡介造血細胞移植治療的疾病與造血細胞的來源
造血幹細胞是能自我更新並能分化成任何血球系列的細胞,它可獲自病人自體的、同基因的雙胞胎,或血親的或非血親的異體。
一. 造血細胞移植治療的疾病(Diseases treated with hematopoietic
cell transplantation):
惡性疾病是造血細胞(hematopoietic progenitor cells,HPCs)移植最常見的適應症。雖然許多非惡性疾病亦曾用救命(life-saving)的角度來使用“移植”來做為治療的方式,但它們在全部的移植量小於15%。造血細胞移植的成功率,端視病人的情況、年齡、被治療疾病的類型和進程、移植細胞的數量、及捐贈者與病人間人類白血球抗原(HLA)配合的程度等條件而定。整體而言,對不同致命性疾病的長期存活率通常有30%至60%的助益。表1為摘錄一些疾病移植的結果。
二. 造血細胞的來源(Sources of hematopoietic progenitor
cells):
骨髓是傳統造血細胞移植的來源。但在1998-2000年國際骨髓移植登記處(International Blood Marrow Transplant
Registry)的報告,經由分離術的週邊血液造血細胞(HPC-A)移植,在成人自體移植約佔90%及異體移植則佔50%。至於兒科病人則已證明使用臍帶血造血細胞移植的成績有令人鼓舞的結果。
(一)自體骨髓的造血細胞(HPCs from autologous marrow):目前自體移植的來源是用骨髓的造血祖細胞者(HPC-M)僅佔5%。這種來源已大半被自體週邊血液分離的造血細胞(HPC-A)所取代。
(二)異體骨髓的造血細胞(HPCs from allogeneic marrow):因為罹患惡性疾病的病人,無法獲得完全沒有腫瘤的移植物來做自體移植,且在移植後不能以移植物抗腫瘤效應來救援。對於其他的病人,諸如骨髓衰竭症、免疫缺乏症、先天性代謝異常及血色素疾病等,異體移植是唯一的選擇。異體HPC-M的捐贈者,可能是配對完全吻合的或部分吻合的親屬或非親屬:
1.配對完全吻合的非親屬捐贈者移植(matched, unrelated donor transplantation):有60-70%的病人沒有HLA-完全相同的同胞兄弟或姐妹做為捐贈者,因此需要尋找配合的非血親捐贈者。目前全球有數個骨髓捐贈者之資料庫可供利用。最大的是美國國家骨髓捐贈者計劃(National
Marrow Donor Program, NMDP)資料庫。它自從於1986年創立以來,NMDP已安排大約12,000個移植案例,每年移植的總個案數超過2000個。
美國國家骨髓捐贈者計劃正在執行的臨床試驗,是用顆粒球集落刺激因子(G-CSF)刺激非親屬志願捐贈者,來收集HPC-A。捐贈者對執行此程序時的身體狀況、態度與情緒均予監測記錄。應用HPC-A的可能優點為改進植入的動力學並增大移植物抗白血病效應(graft-vs.-leukemia
"GVL" effect)。在異體親屬移植的臨床試驗中,將HPC-M和HPC-A二者相比較,後者所顯示的存活期則有所改進。雖然慢性GVHD是HPC-A組的問題,但大多數是可以治療的,而改善這些病人的存活期。
最初,接受配對完全吻合的非親屬移植者為慢性骨髓性白血病(CML)。由於imatinib mesylate藥物的發明,已使CML的治療發生革命性的改變,目前最常見的異體移植治療的適應症有:急性白血病、非何杰金氏淋巴瘤、多發性骨髓瘤及其他疾病的骨髓衰竭症(如再生不良性貧血症)等。
傳統上,第I類HLA抗原(HLA-A及HLA-B)是依賴血清學技術分型的。但它有可能在移植後發生移植物抗宿主病(GVHD)的併發症和移植失敗的結果,這是因為應用表現型相配合的非親屬捐贈者具有不能經由血清學相配合的技術鑑定重大差異的異體抗原(alloantigens)。
移植物抗宿主疾病在HLA第II類抗原不同的危險比第I類抗原不同者為大。HLA-DR和HLA-DQ的HLA分型法,常規係以DNA為基礎的技術實行。分子技術提供更大的解析度,包括對位基因的亞型(subtypes
of alleles),利用傳統血清學技術鑑定為交叉反應組抗原(cross-reactive groups)。單個第I類或第II類抗原的不吻合,對於存活期沒有影響,但死亡率則隨多個第I類抗原不吻合或第I類和第II類抗原同時不吻合而增加。最近的研究證明,在GVHD的發生中,受贈者HLA-DRB1和HLA-DQB1對位基因的不同是很重要的。隨著更多分子分型和移植結果的經驗,將可以說明移植的細胞能成功的容忍不同特異性對位基因的程度。HLA-A、-B及-DR抗原不同的重要性雖為大家所熟知,但HLA-C抗原不同的意義則在調查中。HLA-C抗原分型法曾因不良的血清學鑑定而受阻,而它的臨床意義也被思考過,但直到目前為止,只知在T-細胞免疫反應中扮演較次要的角色,是因為它簡化的多態性和低濃度的細胞表現表達所致。最近的研究顯示,HLA-C抗原能被異體反應性細胞毒殺性T淋巴細胞和自然殺手細胞所認出,這可能是移植失敗增加的因素之一。
2.移植物抗宿主疾病(graft-vs.-host disease,GVHD):HLA抗原不吻合的移植結果,包括移植物排斥(graft rejection)、宿主抗移植物反應(host-vs.-graft
reactions)及移植物抗宿主反應(graft-vs.-host reactions)。急性GVHD的定義為,移植的細胞在植入的初期會攻擊受贈者的組織-時間是在植入後的100天內發生。皮膚、胃腸道及肝臟是最常被侵犯的部位,但通常不會同時發生。發生的等級會因發生的部位及嚴重程度而有所不同。配對不相合的移植,GVHD的危險性更高。
慢性GVHD的特徵,是在移植後數月或在急性GVHD後自然發生的(通常在移植後100天),並可嚴重的影響病人的生活品質。除發現於急性型的症狀外,可發生慢性自體免疫型症狀,如膽汁性硬變、謝格連氏症候群及全身性硬化,是因為捐贈者的免疫細胞攻擊接受者的唾液腺分泌上皮細胞、膽管的分枝或結締組織所致。在一個大型異體移植病人的研究中,發生慢性GVHD的病人,其存活期超過100天的有55-65%。急慢性的GVHD都會傷及病人的免疫系統而使病人容易發生感染。為了減少或去除這類病人的GVHD,造血祖細胞(HPCs)可先接受T-細胞減除術(reduction
depletion)的程序,同時給病人預防性的免疫抑制劑來克服。
有報告顯示有輕微的GVHD的發生可以減少白血病的復發及改善整體存活期有關。相信這樣的GVL效應是移植物第二次攻擊殘餘的惡性細胞所致。另一種主要的臨床挑戰,是使GVL效應增至最大的限度,同時使GVHD的後遺症減至最小的程度。GVL效應的機制雖未完全了解,但來自捐贈者的細胞毒殺性T-細胞對病人的次要組織配合抗原(minor
histocompatibility antigens)具有特異性,可能是促成此效應發生的原因。在異體移植後容易發生白血病復發的病人中,曾嘗試用捐贈者的T淋巴細胞輸注(donor
lymphocyte infusion,DLI)來誘導發生GVL效應。為了創造沒有嚴重GVHD的GVL效應,使用的策略是控制滴注捐贈者淋巴細胞的數量,直到病人發生II-III級的GVHD為止。但能誘發沒有重大GVHD的GVL效應,所需最理想的捐贈者淋巴細胞數量為何則尚不知。免疫抑制、T細胞輸注的數量、T-細胞表現型、骨髓抑制及治療性T細胞的DLI時間之安排,都在GVL效應和GVHD之間扮演平衡之角色。此GVL效應在CML有最多的論述,而在AML、ALL及其他淋巴組織惡性病的記述則較少。
但因為難以確定良好的HLA抗原配對,所以異體移植伴隨的主要危險有:免疫活性的捐贈者T細胞與受贈者組織產生反應,而引發GVHD。即使HLA抗原完全相同(6個抗原相合)的捐/受成對,也有高達6%移植失敗及20-60%病例發生GVHD,這係因為有核細胞顯示的次要組織配合抗原不與主要組織配合複合體抗原相關聯所致。目前改進的HLA分型技術是採用分子的技術,能給予抗原作圖(antigen
mapping)及完全相同/不完全相同圖像(match / mismatch picture)更完整的圖型,但許多配對測定的血清學術語仍常用作臨床敘述的參考。縱使在移植程序完成後給予免疫抑制療法,仍會發生GVHD。新發現的免疫細胞處理方法有癌症控制效應,而避免不想要的GVHD之後果。體外光分離術可用來治療發生GVHD的病人,並可減少免疫抑制藥的劑量。
(三)週邊血液分離術的自體造血祖細胞(HPCs by autologous apheresis):自體造血細胞(autologous HPC-A)的收集,是以造血生長因子(最常用者為G-CSF)動員病人骨髓腔的造血細胞快速進入週邊血液,在收集前可用或不用化學療法處理。一旦造血細胞進入週邊血液循環,即以白血球分離術來收集。HPC-A收集不會有麻醉的風險,是非侵入性的,且所含的腫瘤細胞要比由骨髓所收集的造血細胞來得少。
(四)異體分離術的造血細胞(HPCs by allogeneic apheresis):
1.親屬的移植(related transplantation):用HLA完全相配合的親屬捐贈者(六個HLA完全相配合的最佳機率是在病人的姐妹和兄弟之中間),對成人異體移植而言會有最好的臨床結果;雙親和子女將至少是單倍型相配合的。
在遺傳學上,同胞(sibling)完全相配合的機率為25%,單倍型相配合(haplotype match)的機率為50%及完全不相合的機率為25%。兒科病人能耐受部分不相配合的移植物,所以有較多的捐贈者可用。在稀有的實例中,受贈者可能有一個完全相同的雙胞胎(identical
twin),可能是最佳的同基因移植(syngeneic transplant),因為捐贈者與受贈者的細胞在遺傳上完全相同,這樣的好處是GVHD的危險是比較少的。但發現同基因的移植物(syngeneic
graft)不會提供移植物抗腫瘤效應,可能是缺點之一。
親屬移植的分離術造血細胞(HPC-A)已大半取代骨髓的造血細胞(HPC-M)。在健康捐贈者應用G-CSF,以證明對異體移植可動員足夠的造血幹細胞,因此可免除麻醉與骨髓收穫的需要。臨床的數據將完全相同的同胞的異體HPC-A和異體HPC-M相比較,顯示HPC-A的受贈者有較快的植入(faster
engraftment)、免疫重建、較低的移植物相關死亡率,而急性GVHD的發生率則相同。回溯性的分析報告,慢性GVHD的發生率較高;但最近預期的隨機研究發現,慢性GVHD的危險沒有差別。
(五)臍帶血的造血細胞(HPCs from cord blood):儘管美國國家骨髓捐贈計劃(NMDP)所登記的資料庫已超過300萬筆,但由於需要接受異體造血細胞移植的病人,可以發現一位相合捐贈者的機率小於85%。對於已發現且有資格的HPC-A或HPC-M願意捐贈者,若要實施收集往往也需要數週之久,由於時間等的限制,因此臍帶血造血細胞(HPC-C)的應用就被廣泛注意。臍帶血作為HPCs移植來源的優點包括:a.
對捐贈者(新生兒及母親)沒有危險及痛苦;b. 少數民族的臍帶血可就近獲自大型捐髓中心(如NMDP);c. 移植的臍帶血可迅速利用(時效性高);d.
不必擔心捐贈者可能拒絕;e. 發生病毒感染和GVHD的風險較低;f. HLA配對要求的條件比較低。而有關臍帶血造血細胞移植的考量包括:a.
倫理道德與正式同意書問題;b. 植入的速率;c. 移植後期的較高死亡率;及d. 達到成人植入的能力(因為臍帶血內有核細胞數量的限制)。自從1989年報告首例臍帶血移植於范康尼貧血症(Fanconi
anemia)以來,在種種血液惡性病和非惡性情況已接受臍帶血的病人超過2500例之多。
活體外的數據提示,臍帶血具有增大的增殖能力。臨床的研究已報告移植後嗜中性白血球植入到達500/μL的中間時間為30天;血小板植入到達50,000/μL的中間時間為56天。和異體骨髓移植後觀察的植入相比較,達到嗜中性白血球與血小板植入的時間較長。臨床的研究亦曾提示非親屬的HPC-C移植,在小兒發生GVHD的危險比非親屬HPC-M移植者為低。
新近的臨床試驗正在做多個HPC-C單位來做成人移植看是否可以接受,因為HPC-C會使植入的時間縮短。一研究23位這種罹患晚期疾病的病人,顯示平均的嗜中性白血球植入時間為23天,及一年後無病存活期機率為57%。在這些2單位的移植中,其中
1單位的細胞佔優勢並提供持久的植入族群(lasting engraftment population)。有關臍帶血移植的分類,簡述如下:
1.親屬臍帶血捐贈者(related cord blood donors):源於臍帶血液的同胞(sibling-derived cold blood),曾被用作造血植入的來源,在歐洲及北美洲有超過250個異體移植,佔了所有異體臍帶血移植的15%。造血恢復的動力學和非親屬臍帶血受贈者相似。血小板和嗜中性白血球二者植入的時間均較HLA-相合同胞骨髓移植為慢。但HLA-完全相同同胞臍帶血的受贈者,急性和慢性GVHD的發生率均較HLA-完全相同同胞骨髓的受贈者為低。
2.自體臍帶血液(autologous cord blood):為預防小兒可能需要臍帶血液,臍帶血銀行可以其長期冷凍貯存嬰兒的臍帶血細胞。18歲需要臍帶血移植的個體,被估計的機率為20萬分之一。首例成功的自體臍帶血移植是一個14個月大罹患神經母細胞瘤(neuroblastoma)的病人。
3.臍帶血銀行(cord blood banks):第一個大規模社區臍帶血液計劃是美國紐約血液中的胎盤血計劃(Placental Blood
Program),並在1992年開始收集胎盤血液。此計劃已貯存的臍帶血單位超過14,000個,並已提供超過1,500次的移植治療。最初的562例移植結果的細節已經有了報告。NMDP已發展參與臍帶血庫的登記處。紐約血液中心臍帶血庫及遍佈全球的臍帶血、骨髓捐贈者網路登記處,都是今日尋找臍帶血的場所。
三. 造血細胞移植捐贈者的合格性(Donor eligibility):
1.自體移植的評估(donor evaluation: autologous setting):自體HPC-M應首要評估病人骨髓殘留的惡性疾病和骨髓的細胞結構。等待移植的病人,應執行完整的病史和身體檢查,以鑑定出骨髓抽取或週邊幹細胞分離術的任何危險。
2.異體捐贈者的評估(donor evaluation: allogeneic setting):異體捐贈者的選擇須依其HLA抗原配對的程度;合格證明須依據FDA的規範、AABB、NMDP及細胞治療認證基礎(FACT)的標準;及捐贈者身體的狀況與接受收集程序的意願等而定。最理想的應以全部6個抗原的相合;不過也曾經有1個抗原不相合及單倍型相同的異體移植。在CMV陰性受贈個案的選擇過程中,捐贈者的CMV狀態是很重要的因素。應用經產婦女或性別不配合的個體為捐贈者,由於在捐贈者中的輸血史,有伴隨GVHD增加的危險。因此,優先的HLA抗原相同的捐者,應是CMV陰性(在CMV-陰性受者的個案);和受者性別相同的;倘若為女性,應為非經產的及未輸血的。
3.感染性疾病的檢測(infectious disease testing):自體的和異體的捐贈者,均須篩檢並檢測某些感染性疾病。捐贈者必須被篩檢,俾使疾病傳播至已經免疫缺乏的受贈者的危險減至最低程度。FDA規範明確規定,造血細胞捐贈者的標本,常態化的檢測係在收集前七天或在收集的時間,而不是在造血細胞發出之前。分離術捐贈者之造血祖細胞(HPC-A)用來檢驗感染與否的標本,可在收集前30天收集,方便在病人開始骨髓摧毀性化療前完成所有的感染性試驗。
應用對HIV和HCV核准的核酸試驗,現已大大縮短了捐贈者可能的“空窗期”(window period,即為已受這些感染而尚未對抗體試驗呈現陽性的捐贈者)。由於應用血球生長激素刺激捐贈者以利收集造血細胞,這很有可能使目前用於感染性疾病的免疫分析法發生假陽性反應,例如B型肝炎表面抗原與HCV病毒曾在正常捐贈者中發現有假陽性反應結果。
證實為HIV陽性的捐贈者,不能用作移植的來源。其他陽性的疾病標誌,不一定禁用於特殊的捐贈者(如抗-HBc陽性)的收集,而具有這種標誌的捐贈者,目前正在被NMDP進行特別評估中。當病人的移植醫師告知受贈者的捐贈者狀態並有該病人文件證明的同意書時,來自這樣的捐贈者是可以被接受的。對於收集的造血細胞,須用隔離貯存的方法直到輸注時為止,以防止其他貯存造血細胞之的交互污染(cross-contamination)。
至於異體臍帶血細胞(HPC-C)移植時,對感染性疾病檢測的標本,應在臍帶血收集之前48小時內從捐贈者的母親處獲得並進行檢測,並將任何陽性的結果報告給母親和該母親的醫師。對於這些案例之HPC-C的捐贈,應予拋棄或該病人須通過特別的通知或書寫同意書的程序。不過,在異體HPC-C移植的案例中,捐贈者與受贈者的CMV狀態仍要予仔細的考慮。若一位受贈者(他或她)為CMV-陰性並接受CMV-陽性的移植物,可能發生原發性CMV感染,但可具有某些保護作用(來自移植物中的免疫力)。CMV-陽性個體接受CMV-陰性的移植物,亦可發生嚴重的原發性感染,這是來自居留於受者組織中的病毒所致。
結語:本文除介紹造血細胞移植的分類及其移植後的療效以及使用的方式外,並對自體和異體捐贈者的條件加以評估與剖析,希望能有助於臨床醫師在執行造血細胞移植作業時的參考。
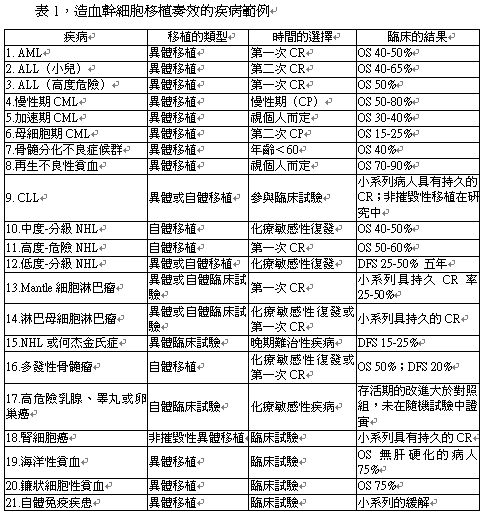
CR:完全緩解 DFS:無病存活期 OS:全部存活期
AML:急性骨髓性白血病 CML:慢性骨髓性白血病
ALL:急性淋巴性白血病 CP:慢性期
NHL:非何杰金氏淋巴瘤(Non-Hodgkin,s lymphoma)
